위암 3·4차 치료제로 FDA 허가 시 韓 최초 블록버스터 항암신약
코오롱생명과학과 헬릭스미스 논란으로 위축됐던 한국 바이오업계가 에이치엘비의 표적항암제 ‘리보세라닙’ 임상 데이터 공개로 호재를 맞았다.
30일 관련업계에 따르면 에이치엘비의 자회사 엘리바는 스페인 바르셀로나에서 개최 중인 유럽종양학회(ESMO)에서 리보세라닙 글로벌 임상시험 3상 결과를 공식 발표했다.
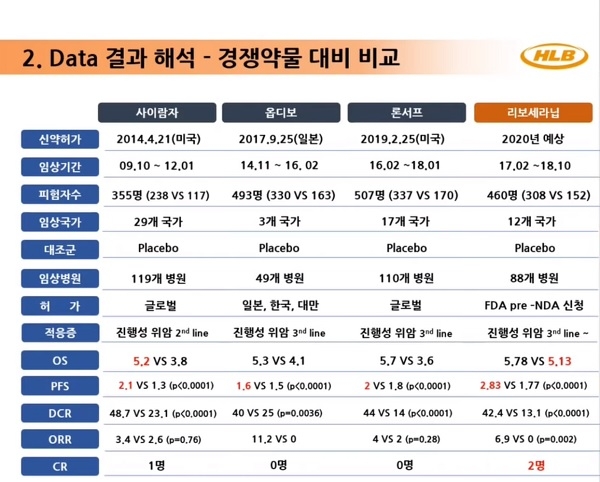
이번 임상은 지난 2017년 2월부터 2018년 10월까지 한국과 미국, 일본 등 12개국 88개 병원에서 위암 2차 이상 표준치료에 실패한 환자 460명을 대상으로 진행됐다. 환자들은 리보세라닙 투약군 308명과 위약군 152명으로 무작위 배정됐다.
1차 유효성 평가지표인 전체생존기간(overall survival, OS)에선 투약군과 위약군이 각각 5.78개월, 5.13개월로 큰 차이를 보이지 않았다. OS는 임상 종료 시점까지 사망하지 않은 환자의 비율을 의미한다.
에이치엘비 측은 이에 대해 임상 도중 3차 치료제가 시판됐고, 특정 국가에서 위약군 환자가 다른 약물을 투여 받으면서 전체 OS 데이터가 왜곡된 결과라고 설명했다.
2차 평가지표인 무진행생존기간(progression-free survival, PFS) 등 다른 데이터에선 리보세라닙의 유효성이 입증됐다는 게 에이치엘비 측 설명이다. PFS는 임상 중인 의약품을 복용하는 동안 병이 악화하지 않은 기간을 말한다. 에이치엘비에 따르면, 투약군의 PFS는 2.83개월로 위약군인 1.77개월보다 1개월가량 길었다.
리보세라닙은 PFS 외에도 객관적반응률(objective response rate, OPR)과 질병통제율(DCR)에서 유의미한 성과를 보인 것으로 전해졌다. OPR은 질병에서 회복된 비율을, DCR은 암세포가 성장을 멈추거나 크기가 줄어든 환자 비율을 말한다. 투약군과 위약군의 ORR은 각각 6.9%와 0%, DCR은 42.49%, 13.1%로 나타났다.
에이치엘비 측은 리보세라닙의 항암효과가 경쟁약보다 우수하고, 부작용 결과도 전체적으로 낮게 나타나는 등 임상 3상이 성공적이라고 자평하고 있다. 아울러 리보세라닙을 위암 3·4차 치료제로 미국 식품의약국(FDA) 신약 허가 신청할 방침이다. FDA가 신약 허가를 내주면 한국에선 최초로 블록버스터 항암 신약으로 인정받게 된다.
에이치엘비 관계자는 “10월 중순부터 FDA와의 미팅을 통해 허가 절차를 진행할 것”이라며 “OS에서 데이터가 오염되긴 했지만, 최근 FDA의 허가 방향이 PFS를 중점적으로 보는 쪽으로 바뀌어 신약 허가가 나올 것으로 기대하고 있다”고 밝혔다.
업계에선 악재가 연이어 겹쳤던 바이오업계에 호재로 작용할 가능성이 크다는 평가가 나온다.
업계의 한 관계자는 “코오롱생명과학과 헬릭스미스 등의 논란으로 바이오업계가 위축됐었는데 리보세라닙 임상 3상에서 유의미한 결과가 나온 것은 긍정적으로 평가할 수 있다”며 “FDA 허가까지 이어질 경우 한국 바이오업계가 다시 활기를 가질 수 있는 계기로 작용할 것”이라고 주장했다.



